2025年05月28日
香港大學李嘉誠醫學院(港大醫學院)的研究團隊提出一種新型癌症治療方法,可以加強癌細胞對氨基酸的「飢餓感」。這項研究發現,癌細胞能夠通過一種名為巨胞飲-蛋白酶體降解途徑的營養代償系統來獲取外部蛋白質,並將其分解成氨基酸,以便在缺乏營養的情況下生存。基於這一發現,研究團隊設計了一種特殊的納米粒子,能夠釋放藥物來阻止癌細胞內吞及降解這些蛋白質,從而實現高效的腫瘤饑餓治療。有關研究成果現已在國際學術期刊《Advanced Science》上發表(按此瀏覽期刊文章),並已提交美國專利申請。
研究背景
根據2022年香港癌症統計數據,肺癌仍是香港最常見的癌症,佔本港癌症新症總數的16.1%。這類腫瘤由於其內部缺乏血液供應,容易形成營養缺乏的腫瘤微環境,導致氨基酸和葡萄糖等重要的營養成分不足。過往研究指出,癌細胞能夠攝取周圍的蛋白質,通過溶酶體途徑降解蛋白質,為癌細胞提供氨基酸來源,但其他蛋白質降解途徑是否在其中也起到重要作用尚不明確。
研究方法及結果
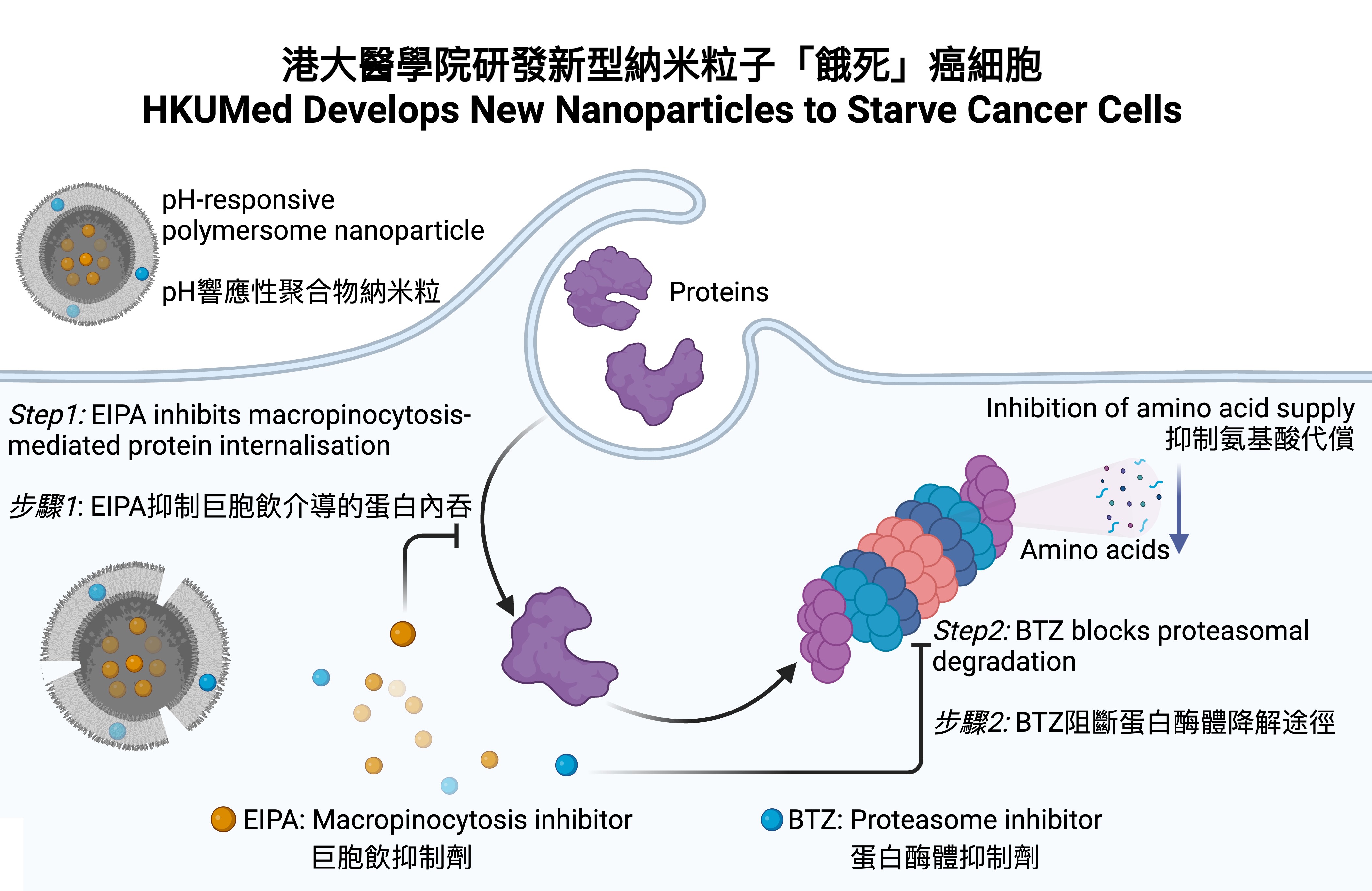
在這項研究中,團隊發現癌細胞的巨胞飲-蛋白酶體降解過程可以作為細胞外蛋白質內化和降解的一種途徑。癌細胞在氨基酸不足的環境下,通過巨胞飲作用攝取外部蛋白質,並通過活化蛋白酶體途徑進行降解。為阻斷這一降解過程,研究團隊開發了一種新型pH響應性聚合物納米粒子用於共同遞送巨胞飲抑製劑和蛋白酶體抑製劑。
在一項實驗中,研究團隊將納米粒子注射到肺癌小鼠模型中,結果顯示這些納米粒子在到達酸性腫瘤微環境後,能有效釋放藥物,阻斷癌細胞內吞外源性蛋白及細胞內蛋白的降解,從而達到協同腫瘤饑餓治療的效果。
研究意義
港大醫學院藥理及藥劑學系、李達三博士研究中心副教授以及生物醫藥技術國家重點實驗室首席調查研究員汪衛平教授表示:「不同於傳統的溶酶體蛋白降解途徑,研究團隊發現巨胞飲-蛋白酶體途徑可以作為另一種細胞外蛋白質攝取降解過程,以支援癌細胞存活。這一新機制提示巨胞飲-蛋白酶體降解體系可成為另一種腫瘤饑餓治療的關鍵靶點。」此外,為了促進該策略的臨床轉化,研究團隊開發了一種新型pH響應性聚合物納米粒子來抑制癌細胞的氨基酸水平,從而達到腫瘤饑餓治療的效果。汪教授補充:「這項研究聚焦於蛋白質內吞、降解代謝過程,為癌症饑餓治療提供了新的策略。」
研究團隊
此項目由港大醫學院藥理及藥劑學系、李達三博士研究中心副教授以及生物醫藥技術國家重點實驗室首席調查研究員汪衛平教授領導。同一學系的博士畢業生王天一博士和博士後研究員張雅茗博士為共同第一作者。
鳴謝
此項研究獲得國家自然科學基金(優秀青年科學基金項目)的支持。